Obtenga la información más reciente de la FDA para ayudarle a tomar una decisión informada sobre el uso o no implantes de seno.
¿Debería ponerme implantes de seno? ¿Deberían ser de solución salina o de silicona? ¿Qué estilo? ¿Cuánto monitoreo se necesita después de la cirugía?
Esas son preguntas comunes que las personas tienen cuando consideran los implantes de seno.
Es por eso que la Administración de Alimentos y Medicamentos de los EE. UU. (FDA, por sus siglas en inglés) ofrece la siguiente información (en inglés) para ayudar a las personas a tomar decisiones sobre los implantes de seno.
La FDA ha aprobado implantes para aumentar el tamaño de los senos, para la reconstrucción después de una cirugía o trauma a causa de cáncer de mama, y para corregir defectos de desarrollo. La FDA también ha aprobado implantes de seno para corregir o mejorar el resultado de una cirugía previa.
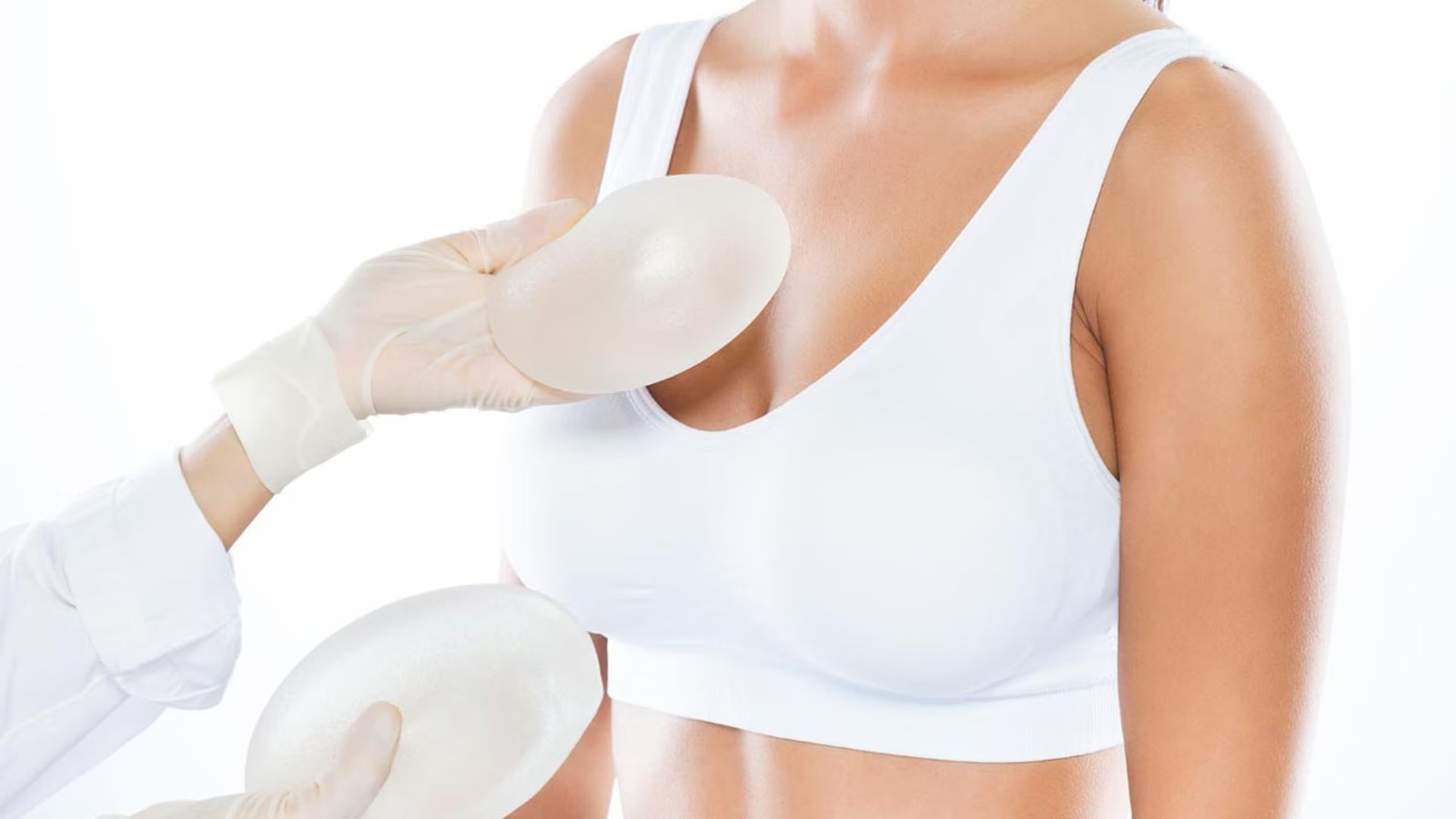
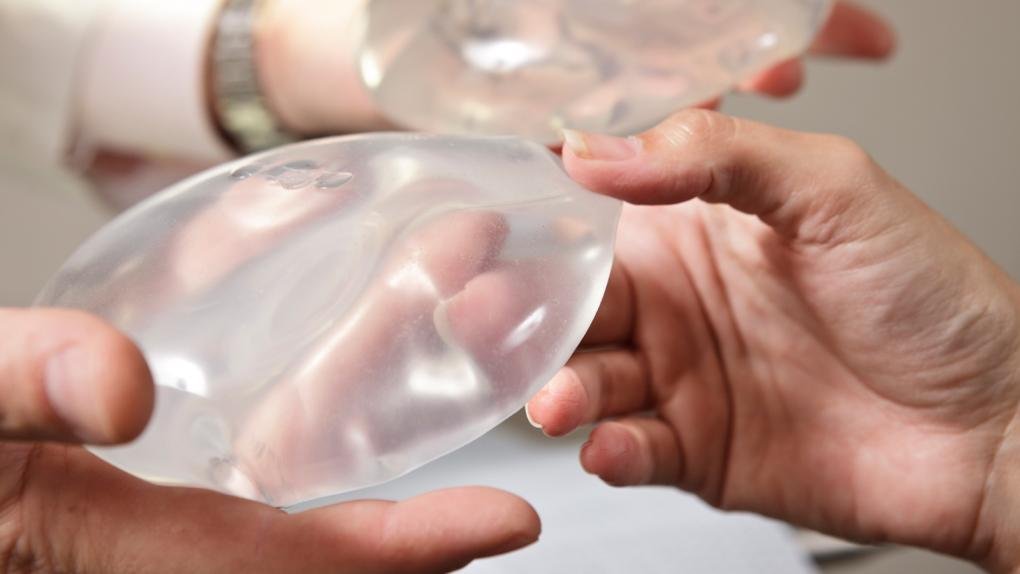
Hay dos tipos de implantes de seno aprobados por la FDA: los rellenos con solución salina (solución de agua salada) y los rellenos de gel de silicona. Ambos tienen una cubierta exterior de silicona y varían en tamaño, grosor de la cubierta, textura de la superficie de la cubierta y forma (contorno).
Conozca los riesgos de los implantes de seno
Los implantes aprobados por la FDA se someten a pruebas exhaustivas antes de su aprobación para demostrar una garantía razonable de seguridad y eficacia. Aun así, existen riesgos asociados a todos los implantes de seno (en inglés), entre ellos:
- Cirugías adicionales
- Linfoma anaplásico de células grandes asociado a implantes de seno (BIA-ALCL, por sus siglas en inglés) (en inglés), que es un cáncer del sistema inmunológico
- Síntomas sistémicos, comúnmente denominados como Enfermedad de los implantes de seno (BII, por sus siglas en inglés)
- Contractura capsular (tejido cicatricial que aprieta el implante)
- Dolor en los senos
- Ruptura (desgarros o agujeros en la cubierta) de los implantes rellenos con solución salina y con gel de silicona
- Desinflación (con cambio visible en el tamaño de los senos) de los implantes rellenos con solución salina
- Ruptura silenciosa (sin síntomas) de implantes rellenos con gel de silicona
- Infección
La silicona utilizada para los implantes de seno es diferente a la silicona inyectable. La silicona inyectable no está aprobada por la FDA para el aumento de senos, la reconstrucción de senos o el contorno corporal.
Los implantes de seno no son dispositivos de por vida
Cuanto más tiempo tenga los implantes de seno, mayores serán las posibilidades de que desarrolle complicaciones, algunas de las cuales requerirán más cirugía.
La vida útil de los implantes de seno varía según la persona y no se puede predecir. Eso significa que todas las personas con implantes de seno pueden necesitar cirugías adicionales, pero nadie puede predecir cuándo. Los pacientes también pueden solicitar cirugías adicionales para modificar el tamaño o la forma de sus senos.
Entienda las etiquetas de los implantes
Para ayudar a los pacientes a ser conscientes de los riesgos de los implantes de seno antes de la cirugía, la FDA exige que todos los implantes de seno aprobados por la FDA incluyan etiquetas con información fácil de entender sobre los beneficios y riesgos asociados con el producto. Este requisito tiene como objetivo mejorar las conversaciones que los pacientes tienen con su médico sobre los beneficios y riesgos de los implantes. La información obligatoria de la etiqueta incluye una lista de verificación de las decisiones del paciente que destaca la información clave sobre los riesgos; información de advertencia en forma de recuadro para hacerla visible; y una tarjeta del dispositivo para el paciente con información específica del implante del paciente, como el número de serie o lote, y el estilo y tamaño.
La FDA restringe la venta y distribución de implantes de seno solo a los proveedores de atención médica y a las instalaciones que brindan información a los pacientes utilizando la lista de verificación de decisiones del paciente. El paciente debe tener la oportunidad de poner sus iniciales y firmar la lista de verificación antes de aceptar la cirugía y debe estar firmada por el médico que implanta el dispositivo.
Además, la FDA aconseja a los pacientes que lean el Resumen de datos de seguridad y eficacia (en inglés) y la etiqueta del producto de cada implante para conocer los materiales utilizados para construir el dispositivo, las características del mismo y los rellenos utilizados. El Resumen de datos de seguridad y eficacia se ha elaborado para todos los implantes de seno de solución salina y de silicona aprobados. El Resumen de datos de seguridad y eficacia y la etiqueta del producto proporcionan información sobre las indicaciones de uso, los riesgos, las advertencias, las precauciones y los estudios asociados a la aprobación del dispositivo por parte de la FDA.
El Resumen de datos de la seguridad y eficacia también proporciona información sobre el estudio clínico utilizado para la aprobación del dispositivo. Las complicaciones más graves son las que conducen a nuevas cirugías, como rupturas o la contractura capsular, o el diagnóstico de BIA-ALCL.
Hable con su cirujano
Los cirujanos evaluarán la forma, el tamaño, la textura de la superficie, la colocación del implante y el lugar de la incisión para cada persona. Pregúntele a su cirujano sobre su experiencia en la realización de cirugías de implantes de seno, el procedimiento quirúrgico y las formas en que el implante podría afectar su vida.
Informe a su cirujano sobre cirugías anteriores y la respuesta de su cuerpo. Por ejemplo, mencione si las cirugías resultaron en una cantidad de tejido cicatricial mayor de la esperada. Hable también de sus expectativas. Estas conversaciones le ayudarán a usted y al cirujano a tomar decisiones para lograr la apariencia deseada, incluidas las decisiones sobre la ubicación y el tamaño de la incisión, así como el tamaño, el material, la textura y la colocación del implante.
Muchos pacientes se someten a operaciones adicionales para cambiar el tamaño del implante. Para lograr los mejores resultados después del primer procedimiento, es necesaria una planificación cuidadosa y expectativas razonables.
Conozca los riesgos a largo plazo de los implantes de seno
La FDA ha identificado una asociación entre los implantes de seno y el desarrollo del linfoma anaplásico de células grandes asociado a implantes de seno (BIA-ALCL), un tipo de linfoma no hodgkiniano. Los pacientes con implantes de seno pueden tener un mayor riesgo de desarrollar este cáncer, que se desarrolla principalmente en el líquido o tejido cicatricial que rodea al implante.
Los implantes de seno tienen superficies lisas o texturizadas (cubiertas). El BIA-ALCL se desarrolla con más frecuencia en pacientes con implantes texturizados que en aquellos con implantes de superficie lisa. Como otros linfomas, el BIA-ALCL es un cáncer del sistema inmunológico y no del tejido mamario.
Algunas pacientes con implantes también han reportado problemas de salud como enfermedades del tejido conectivo (como lupus y artritis reumatoide), problemas de lactancia o problemas reproductivos. Actualmente, no hay pruebas suficientes que apoyen una asociación entre los implantes de seno y esos diagnósticos.
Además, algunos pacientes que recibieron implantes de seno han reportado una variedad de síntomas sistémicos como dolor en las articulaciones, dolores musculares, confusión, fatiga crónica, enfermedades autoinmunes y otros. El riesgo individual de las pacientes de desarrollar estos síntomas no ha sido bien establecido.
Monitoree sus implantes de seno
En general, siga las instrucciones de su cirujano sobre cómo monitorear sus implantes de seno.
Si nota algún signo o síntoma inusual, repórtelo de inmediato a su cirujano o proveedor de atención médica. Se recomienda a los proveedores de atención médica y a los pacientes a que reporten los eventos adversos o efectos secundarios relacionados con el uso de estos productos al Programa de Información de Seguridad y Reporte de Eventos Adversos de MedWatch de la FDA (en inglés).
Además, siga las instrucciones de su proveedor de atención médica para la toma de imágenes para la detección del cáncer de mama, ya que esto puede ser diferente para los pacientes que se sometieron a un aumento de senos y para los pacientes que se sometieron a una reconstrucción de seno. Si va a programar una cita para una mamografía, informe al centro de mamografía que tiene implantes de seno y pregúnteles qué puede esperar con respecto a la mamografía con implantes de seno.
Su cirujano o proveedor de atención médica también puede recomendar otras pruebas, como el ultrasonido o la resonancia magnética (MRI, por sus siglas en inglés). La FDA recomienda que los pacientes con implantes de silicona realicen exámenes periódicos para detectar rupturas silenciosas.
Si tiene preguntas específicas sobre los implantes de seno, consulte a su cirujano o proveedor de atención médica.
Get the latest information from the FDA to help you make an informed decision about whether or not to use breast implants.
Should I get breast implants? Should they be saline or silicone? What style? How much monitoring is needed after surgery?
These are common questions people have when considering breast implants.
That’s why the U.S. Food and Drug Administration (FDA) offers the following information to help people make decisions about breast implants.
The FDA has approved implants to increase breast size, for reconstruction after surgery or trauma due to breast cancer, and to correct developmental defects. The FDA has also approved breast implants to correct or improve the outcome of a previous surgery.
There are two types of FDA-approved breast implants: those filled with saline (saltwater solution) and those filled with silicone gel. Both have a silicone outer shell and vary in size, shell thickness, shell surface texture, and shape (contour).
Learn About The Risks Of Breast Implants
FDA-approved implants undergo extensive testing before approval to demonstrate reasonable assurance of safety and effectiveness. Still, there are risks associated with all breast implants , including:
- Additional surgeries
- Breast implant-associated anaplastic large cell lymphoma (BIA-ALCL) , which is a cancer of the immune system
- Systemic symptoms, commonly referred to as Breast Implant Illness (BII)
- Capsular contracture (scar tissue that squeezes the implant)
- Pain in the breasts
- Rupture (tears or holes in the shell) of saline-filled and silicone gel-filled implants
- Deflation (with visible change in breast size) of saline-filled implants
- Silent rupture (without symptoms) of silicone gel-filled implants
- Infection
The silicone used for breast implants is different than injectable silicone. Injectable silicone is not FDA approved for breast augmentation, breast reconstruction, or body contouring.
Breast Implants Are Not Lifelong Devices
The longer you have breast implants, the greater the chances that you will develop complications, some of which will require more surgery.
The lifespan of breast implants varies from person to person and cannot be predicted. This means that all people with breast implants may need additional surgeries, but no one can predict when. Patients may also request additional surgeries to modify the size or shape of their breasts.
Understanding Implant Labels
To help patients be aware of the risks of breast implants before surgery, the FDA requires that all FDA-approved breast implants include labels with easy-to-understand information about the benefits and risks associated with the product. This requirement is intended to improve the conversations patients have with their physician about the benefits and risks of implants. Required label information includes a patient decision checklist that highlights key risk information; boxed warning information for visibility; and a patient device card with information specific to the patient’s implant, such as serial or lot number, and style and size.
The FDA restricts the sale and distribution of breast implants only to health care providers and facilities that provide information to patients using the Patient Decision Checklist. The patient must have the opportunity to initial and sign the checklist before agreeing to surgery, and it must be signed by the physician implanting the device.
Additionally, the FDA advises patients to read the Summary of Safety and Effectiveness Data (SED) and product labeling for each implant to learn about the materials used to construct the device, the characteristics of the device, and the fillers used. The SED has been developed for all approved saline and silicone breast implants. The SED and product labeling provide information about the indications for use, risks, warnings, precautions, and studies associated with the FDA’s approval of the device.
The Safety and Efficacy Data Summary also provides information about the clinical study used for the approval of the device. The most serious complications are those that lead to further surgery, such as rupture or capsular contracture, or the diagnosis of BIA-ALCL.
Talk To Your Surgeon
Surgeons will evaluate the shape, size, surface texture, implant placement, and incision site for each individual. Ask your surgeon about his or her experience performing breast implant surgeries, the surgical procedure, and the ways the implant might affect your life.
Tell your surgeon about previous surgeries and your body’s response. For example, mention whether the surgeries resulted in more scar tissue than expected. Discuss your expectations, too. These conversations will help you and your surgeon make decisions to achieve your desired appearance, including decisions about incision location and size, as well as implant size, material, texture, and placement.
Many patients undergo additional operations to change the size of the implant. To achieve the best results after the first procedure, careful planning and reasonable expectations are necessary.
Learn About The Long-Term Risks Of Breast Implants
The FDA has identified an association between breast implants and the development of breast implant-associated anaplastic large cell lymphoma (BIA-ALCL), a type of non-Hodgkin lymphoma. Patients with breast implants may be at increased risk of developing this cancer, which develops primarily in the fluid or scar tissue surrounding the implant.
Breast implants have either smooth or textured (coated) surfaces. BIA-ALCL develops more often in patients with textured implants than in those with smooth-surfaced implants. Like other lymphomas, BIA-ALCL is a cancer of the immune system and not of breast tissue.
Some patients with implants have also reported health problems such as connective tissue diseases (such as lupus and rheumatoid arthritis), breastfeeding problems, or reproductive problems. Currently, there is insufficient evidence to support an association between breast implants and these diagnoses.
In addition, some patients who received breast implants have reported a variety of systemic symptoms such as joint pain, muscle aches, confusion, chronic fatigue, autoimmune diseases, and others. Individual patients’ risk of developing these symptoms has not been well established.
Monitor Your Breast Implants
In general, follow your surgeon’s instructions on how to monitor your breast implants.
If you notice any unusual signs or symptoms, report them immediately to your surgeon or health care provider. Health care providers and patients are encouraged to report adverse events or side effects related to the use of these products to the FDA’s MedWatch Safety Information and Adverse Event Reporting Program .
Also, follow your healthcare provider’s instructions for breast cancer screening imaging, as this may be different for patients who have had breast augmentation and patients who have had breast reconstruction. If you are scheduling an appointment for a mammogram, tell the mammography facility that you have breast implants and ask them what you can expect regarding mammography with breast implants.
Your surgeon or health care provider may also recommend other tests, such as ultrasound or magnetic resonance imaging (MRI). The FDA recommends that patients with silicone implants have regular checkups to detect silent ruptures.
If you have specific questions about breast implants, consult your surgeon or health care provider.
U.S. Food & Drugs Administration
09/08/2022
Fuente Original: https://www.fda.gov/consumers/articulos-para-el-consumidor-en-espanol/que-debe-saber-sobre-los-implantes-de-seno